基于桿狀病毒的表達系統
桿狀病毒表達系統是基于感染的系統。它非常適合更大體積的規模放大,并利用非哺乳動物的昆蟲細胞,例如可以在無血清培養基中懸浮生長的草地貪夜蛾 (Sf9)。此外,桿狀病毒本身具有與 rAAV 復制所需的腺病毒輔助功能等效的輔助功能。第1個表達系統是由 Urabe 等人開發的 Three-Bac 系統(圖 3A)。在該系統中,Sf9 細胞被3種不同的桿狀病毒感染:Bac-Rep,在來自 Orgyia pseudotsugata 核型多角體病毒的截短早期啟動子 E1(Δ1E1)的控制下表達 Rep78,以及在桿狀病毒 p10 啟動子控制下表達 Rep52;Bac-VP,在晚期多角體 (polh) 啟動子下表達衣殼蛋白(VP1、VP2 和 VP3),由于 Sf9 的剪接機制低效,剪接內含子被去除;和 Bac-GFP,表達側翼為 AAV 反向末端重復 (ITR) 元件的目的基因。為了確保在 Sf9 細胞中產生 AAV 衣殼,其化學計量比與哺乳動物細胞生產的相似,VP1 基因的起始密碼子 ATG 突變為 ACG,以削弱 Sf9 細胞中 VP1 的表達。在這項研究中,昆蟲細胞中生產的 AAV 載體與哺乳動物細胞中生產的 AAV 載體具有相似的物理和生化特性。病毒滴度產量達到 5×104 vg/cell。因此,1 L Sf9 細胞培養液相當于 500 至 1000 個 HEK293 T-175 搖瓶。盡管有這些有希望的結果,但第一代桿狀病毒系統有一個主要缺點:由于 rep52 和 rep78 之間的同源重組事件導致 Bac-Rep 的不穩定性,因為它們共享相同的重疊序列。這表現為傳代幾代后滴度下降。此外,對 rAAV 感染性至關重要的 VP1 蛋白的表達水平不足。
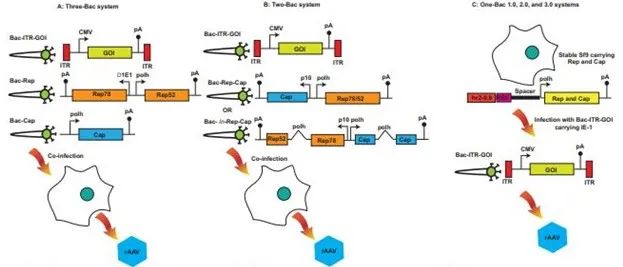
圖3. 基于Sf9的rAAV生產平臺。用于AAV生產的主要Sf9系統從Three – Bac系統 (A) 開始。之后,為了解決Three - Bac系統的穩定性問題,引入了一些改進,從而產生了Two-Bac (B) 和One-Bac版本 (C)。這些改進提高了rAAV的產量,優化了衣殼蛋白質的化學計量學。pA,聚腺苷酸化信號;曲線表示合成內含子在結構中的位置。
A) Three-Bac系統:優勢:1. 易于規模放大;2. 與傳統三質粒轉染相比,rAAV產量較高。挑戰:1. 由于兩個Rep基因之間的同源重組,在幾個傳代之后Rep表達丟失以及rAAV 產量降低;2. rAAV病毒蛋白表達不理想。
B)Two-Bac系統:優勢:1. 易于大體積規模放大,常用于工業應用;2. 與傳統三質粒轉染相比,AAV產量較高;3. Rep-Cap基因盒在傳代后的穩定性更好。挑戰:1. rAAV病毒蛋白表達不理想;2. 重組桿狀病毒構建的時間較長。
C)One-Bac系統:優勢:1. 易于大體積規模放大,常用于工業應用。2. 與傳統三質粒轉染相比,AAV產量較高;3. 通過去除RBE以及引入合成內含子,在2.0版本中引入了多個改進,在3.0版本中,在Kozak序列中引入了更多的優化,以提高VP1表達。挑戰:1.創建穩健Sf9和工程設計重組桿狀病毒的時間較長。
為了克服 Three-Bac 系統的挑戰,幾個研究小組嘗試使用2種不同的方法解決不穩定性問題,并改善 VP1 表達。首先,Rep 和 Cap 載體被進一步修改,以生成一個 Two-Bac 系統(圖 3B),如 Smith 等人所述。Rep78 和 Rep52 通過“泄漏掃描機制”從單個 mRNA 中表達,沒有重復在桿狀病毒多角體啟動子控制下的rep編碼序列。此外,將 Rep78 的起始密碼子突變為弱翻譯起始密碼子 CTG,并通過將接下來的 9 個框內 ATG 更改為非起始密碼子,同時將 Rep52 起始密碼子保留為 ATG進行密碼子優化。遇到次優的翻譯起始信號時,一部分核糖體亞基在該位點開始翻譯,而剩余的 40S 亞基繼續尋找下一個翻譯起始位點。這導致全長 Rep78 和 Rep52 的截短蛋白質序列的表達。在 cap 基因的情況下,其表達由具有起始密碼子 ACG 的桿狀病毒 p10 啟動子驅動。rep 和 cap 基因在一個桿狀病毒構建體中以頭對頭的方向放置,而第2個病毒攜帶兩側為ITR的轉基因。病毒滴度產量達到 7×10^4 vg/cell,但 VP1 的表達水平仍低于瞬時轉染系統產生的表達水平。
在第2種方法中,Chen 將攜帶多角體啟動子的人工內含子引入 p19 啟動子區域的 rep78 編碼序列中,以允許從單個編碼序列表達 Rep78 和 Rep52,這破壞了 Rep78/52 之間的同源區域,而Three-Bac系統保持原樣(圖3B)。類似地,將具有多角體啟動子的內含子引入衣殼編碼序列,以削弱VP1蛋白表達,同時保持瞬時轉染系統產生的化學計量。此外,VP1 的起始密碼子保留為 ATG,與具有 ACG 起始密碼子的情況相比,這導致 rAAV 產品的感染性高出2倍。研究觀察到 rAAV 血清型 1、2、6 和 8 的滴度有所提高,產量范圍為 3.53 × 10^13 至 1.58 × 10^14 vg/L 培養液(圖 3B)。
通過簡單地設計單桿狀病毒系統,對 Two-Bac 系統進行了進一步改進,這是 Mono-Bac 系統的基礎,其中一個桿狀病毒在晚期多角體和 p10 啟動子控制下攜帶所有必要的 rep 和 cap 基因 (Bac-rep-cap)。該盒通過同源重組整合到桿狀病毒基因組非必要的 egt(蛻化類固醇 UDP-葡糖基轉移酶)基因座中,而側翼為 ITR 的轉基因通過 Tn7 轉座酶轉座到 attTn7 位點。
One-Bac 系統由 Aslanidi 等人引入(圖 3C)。在該系統中,通過穩定整合 rep 和 cap 基因,制備了生產 Sf9 細胞系,每個基因均由多角體啟動子和增強子元件 hr2-0.9 控制。生產 Sf9 中使用的 rep 和 cap 基因盒以相同的方式構建,其中每個包含增強子元件 hr2-0.9,然后是 AAV rep 結合元件 (RBE)、填充序列和控制表達的多角體啟動子。在生產 Sf9 中,rep 和 cap 基因的表達保持沉默,直到細胞被攜帶轉基因的桿狀病毒感染,后者側翼為反向末端重復序列和與 hr2-0.9 結合的立即-早期 (IE-1) 轉錄反式調節子目標序列。反式調節子與hr2-0.9 的結合誘導rep 和cap 表達和擴增。與原始桿狀病毒系統相比,這導致每個細胞多達 1200 個拷貝,并且 rAAV 產量增加了 10 倍。
Mietzsch 等人將 One-Bac 系統進一步發展為第二代 One-Bac 2.0。其中 RBE 從 rep 和 cap 基因盒中移除(圖 3C)。這種修改導致了一個仍然有功能的系統,整合的 rep 和 cap 基因的擴增較少,并且這些基因較少被包裹至最終的 rAAV 生產中。通過切換到 VP1 (ATG) 而不是 (ACG) 的原始起始密碼子,并將內含子插入到含有多角體啟動子的 cap 基因中,對該系統進行了更多的修改。這些修改導致 VP1 表達增加,與使用原始 One-Bac 系統產生的 AAV5 相比,AAV5 載體的感染性增加,且前者顯示出較低水平的 VP1 表達。第三代 One-Bac 3.0 通過對翻譯起始密碼子和 Kozak 序列的其它修飾,進一步優化了 VP 的化學計量(圖 3C)。這使 AAV5 和 AAV9 中 VP1 表達水平達到最佳,具有高感染性。One-Bac 系統所依賴的穩定 Sf9 細胞的生成在昆蟲細胞中更具技術挑戰性。因此,常用的系統是 Two-Bac,它結合了 One-Bac 或 Mono-Bac 的簡單性,以及相比 Three-Bac 的相對穩定性。
最近,從親本 Sf9 細胞制備了一個高產克隆 ExpiSf9,并評估了3種 rAAV 血清型的生產。與親本 Sf9 相比,該克隆細胞系的 AAV9、AAV2 和 AAV8 產量分別提高了 7、15 和 19 倍。另一方面,由于固有的非最佳衣殼 VP1 比率,昆蟲細胞產生的 AAV9 的體內轉導效率低于哺乳動物產生的 AAV9 的結果。
盡管最近有所改進,但桿狀病毒系統仍然存在一些限制。VP1、VP2 和 VP3 的桿狀病毒化學計量比仍然不同于哺乳動物產生的 rAAV,需要做更多的工作來確定 rAAV 生產所需的基本桿狀病毒輔助基因。此外,哺乳動物和昆蟲細胞之間衣殼蛋白翻譯后修飾特性的差異、它們對 rAAV 感染性的負面影響、維持桿狀病毒的長期儲備供應、以及傳代次數增加后的不穩定性問題都需要解決。
基于 HeLa 的表達系統
第一代 HeLa 源性穩定包裝和生產細胞系由 Clark 等人開發。這些穩定細胞源自Hela細胞的質粒轉染,后者包括 AAV2 的 rep-cap 基因以及含有藥物選擇標記的 rAAV 載體基因組。多個研究小組對該系統進行了進一步開發,以引入包含 AAV Rep 和 Cap 功能的包裝細胞系,作為中間步驟。其它包裝細胞系由 HeLa 細胞或 A549 細胞創建,其來源于未經病毒轉化的人肺泡細胞癌。用于制備這些穩定包裝細胞的細胞系缺乏腺病毒 E1A/E1B 基因,后者是反式激活 p5、p19 和 p40 以轉錄 rep 和 cap 基因所必需的。因此,它們必須首先感染提供這些功能基因的腺病毒 (E1A/E1B),然后感染 AAV-混合病毒 (Ad-AAV Hyb.virus),這是一種含有側翼為ITR的 rAAV 轉基因序列的腺病毒。使用復制缺陷型腺病毒可避免復制以及隨后對最終 rAAV 產品的污染。已經開發了純化方案,以在生產過程中去除腺病毒(圖 4)。
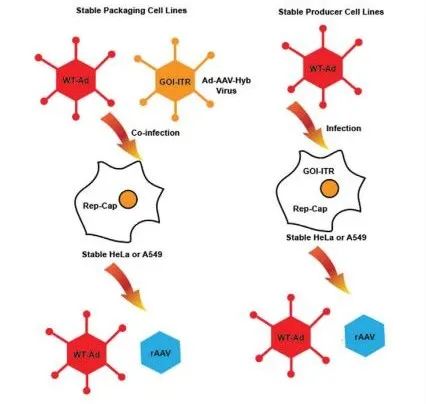
圖4. 基于HeLa的rAAV生產平臺。來自攜帶rep-cap基因的HeLa或A549的穩定細胞系被建立為包裝細胞。細胞同時感染野生型腺病毒和腺病毒-AAV-Hyb病毒,其中側翼為反向末端重復序列的轉基因插入缺失的E1區。當轉基因被穩定地整合到包裝細胞系中時,生產細胞系就建立起來了。用野生型腺病毒感染生產細胞會產生rAAV。在這兩個平臺中,都需要一個清除步驟,來取出污染性野生型輔助病毒。
優勢:1. 容易規模放大;2. rAAV產量提高。挑戰:1. 針對每個特定項目制備Ad-AAV-Hyb病毒載體和穩定細胞系需要很長時間;2. 需要從產品批次中取出殘留的腺病毒;3. 使用HeLa細胞系的安全性問題。
一種復制缺陷型腺病毒在 E2B 基因中具有溫度敏感性突變,只允許病毒在允許的溫度下復制。溫度敏感突變體的缺點是它可恢復為野生型并且難以生產,隨后無法輕松在大規模生產中實施。基于HeLa的穩定細胞系用于生產第一個用于治療囊性纖維化臨床試驗的rAAV產品。該系統的主要優點是無需轉染。rAAV 的生產依賴于用腺病毒感染細胞,如果有一個既定的方案可以從最終的 rAAV 產品中去除污染的腺病毒和病毒蛋白,該系統可以直接規模放大。該系統的缺點是建立穩定包裝/生產細胞系所需的時間較長,以及腺病毒載體的 GMP 原液制備。此外,HeLa 細胞系的使用存在一些安全問題,因為已知它包含編碼人乳頭瘤病毒早期蛋白的幾種致癌基因的多個拷貝。
基于 HSV 1 型的表達系統
單純皰疹病毒 1 型 (HSV-1) 為 AAV 復制提供輔助功能,并且與腺病毒一樣被廣泛研究。與腺病毒相比,HSV-1 復制蛋白直接參與 rAAV 復制,它的基因組為 152 kb 的雙鏈 DNA,編碼超過 80 種蛋白質。基因組分為兩部分,稱為長獨特序列 (UL) 和短獨特序列 (US),側翼為反向重復區域。
HSV-1 中誘導 AAV Rep 表達并隨后導致其復制的必需基因被描述為 HSV-1 解旋酶-引物復合物 (HP) (UL5/UL8/UL52) 和單鏈 DNA 結合蛋白 ICP8 (基因 UL29)。其它對復制不是必需但據報道支持 AAV Rep 表達的輔助基因包括 ICP0(E3 泛素連接酶,HSV-1 基因表達的反式激活因子)、ICP4(一種主要的病毒轉錄因子)和 ICP22(轉錄調節因子)。此外,UL30 和 UL42 是 HSV-1 聚合酶催化亞基,可直接增強 AAV 基因組復制。盡管已證明4種 HSV-1 蛋白(UL5/UL8/UL52 和 ICP8)足以恢復 AAV DNA 復制,但與在所有 HSV-1 基因存在下觀察到的相比,復制效率非常低。完全激活 rAAV 復制還需要其它未知的 HSV-1 因子。事實上,Meier 等人最近已經證明了這一點。HSV-1 支持的 rAAV 基因組復制使用滾環復制 (RCR) 機制,而不是腺病毒支持復制中的鏈置換滾動發夾復制 (RHR) 機制。
Conway等人報道了基于 HSV 擴增子系統的第一代 rAAV 生產方法。在該系統中,AAV2 rep 和 cap 盒被克隆到攜帶 HSV 復制起點和包裝信號的質粒中。為了產生攜帶 AAV2 rep 和 cap 基因的 HSV 病毒,將該質粒轉染到預感染野生型 HSV-1 的 Vero 細胞中,以產生攜帶 AAV2 rep 和 cap 基因的 HSV (HSV-RC)。輔助功能是從野生型 HSV-1 感染前以反式形式提供的。然后將產生的HSV-RC病毒用于感染攜帶整合rAAV盒的HEK293或用攜帶側翼為AAV2 ITR的轉基因的質粒轉染,又或用rAAV2病毒感染。
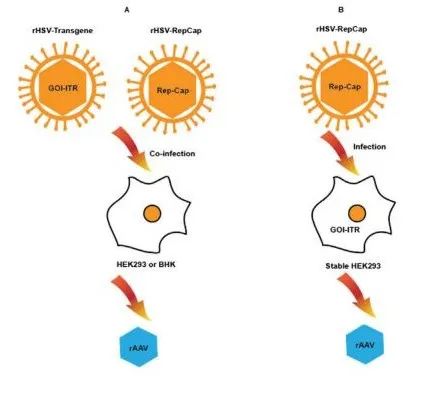
圖 5. 基于 HSV-1 的 rAAV 生產平臺。(A) 用2種復制缺陷重組皰疹病毒 (rHSV) 感染 HEK293 或小倉鼠腎 (BHK) 細胞,病毒攜帶轉基因 GOI,其側翼為 ITR 和 rep-cap 基因盒,實現 rAAV 生產。(B) 或者,如最近報道的,具有轉基因 GOI 的穩定細胞系被攜帶 rep-cap 基因盒的單一病毒感染,這也可實現 rAAV 生產。
優勢:1. 容易規模放大;2. rAAV產量提高;3. 使用單一rHSV感染的商品成本較低。挑戰:1. 針對每個特定項目制備rHSV載體和穩定細胞系的時間較長。2. 需要從產品批次中去除殘留的rHSV蛋白/DNA。
盡管這種方法可生產 rAAV,但產量很低,并且 HSV-RC 在幾次傳代后逐漸丟失。此外,除了細胞病變效應以及隨后降低的 rAAV 產量外,出于安全考慮,使用野生型 HSV-1 是不可取的。去除上游工藝中產生的野生型或其它活病毒需要強大的純化工藝步驟,這通常會導致顯著的收率損失,并且還可能存在規模放大問題。同一研究小組對該方法進行了進一步改進,制備了具有 ICP27 編碼基因 (UL54) 缺失的 HSV 突變體,這導致了觀察到的細胞病變效應。這些變化顯著降低了細胞毒性并增加了 rAAV 的產量。
Conway 等人還引入了第二代方法,其中擴增子被重組 HSV (rHSV) 感染取代(圖 5A)。AAV-2 rep-cap 盒被插入胸苷激酶(TK ) 通過同源重組獲得 ICP27 缺陷型 HSV 基因座并在 V27 細胞中繁殖,以產生 rHSV 病毒。V27 細胞是穩定攜帶 UL54 基因的 Vero 細胞的衍生物,該基因編碼反式提供的 ICP27 蛋白,以產生 rHSV。在使用 rHSV 感染穩定攜帶 rAAV 轉基因盒或用含有 rAAV 轉基因盒的質粒轉染或感染 rAAV 病毒的 HEK293 細胞后,這些改進提供了更高的 rAAV 產量。此外,細胞病變效應(ICP27 蛋白)被阻止,HSV-1 輔助功能和 rep-cap 基因都被傳遞到單個感染載體上。該系統是使用貼壁細胞開發的,并且仍然依賴于質粒的轉染,這導致了一些限制。
該平臺開發的下一步是擺脫貼壁細胞并實施無轉染系統。Hwang等人使用 ICP27 缺陷型 HSV-1 生成兩個攜帶轉基因的 rHSV 載體,側翼為 AAV2 ITR 和 AAV-rep-cap 盒(圖 5A)。通過同源重組將盒插入胸苷激酶 (TK) 基因座。兩種 rHSV 載體用于在培養瓶中共感染 HEK293 細胞。相對于 HEK293 細胞中的瞬時轉染或單一 rHSV 感染,觀察到 rAAV 產量顯著增加。使用適合在懸浮無血清培養中生長的幼倉鼠腎細胞 (BHK) 可以降低感染復數 (MOI) 并規避 Rep 蛋白的輕微毒性。此外,與 HEK293 細胞相比,BHK 細胞具有生長快、感染性強的優勢。這隨后導致在共感染期間使用較低的 MOI。最近,兩個小組通過比較 rHSV 和基于瞬時轉染的貼壁及懸浮 HEK293 培養平臺來研究 rAAV9 產品的產量和質量,并報告說這兩種方法對于表達微肌營養不良蛋白的rAAV9的產量和效力相同。在懸浮 Expi293F 的情況下,rHSV 方法的產量和完整衣殼百分比更高,殘留的宿主細胞蛋白和輔助 DNA 更少,同時相比瞬時轉染懸浮培養,檢測到更高的 HSV DNA。
Selvaraj等人介紹了對基于 rHSV 的方法的進一步改進,其中,以 HEK293 開發了一個穩定的細胞系,其攜帶一個側翼為 AAV2 ITR 和選擇標記的 rAAV 轉基因(圖 5B)。僅使用一個 rHSV-rep-cap病毒感染貼壁細胞,選擇高 rAAV 生產細胞系后,他們在最后的純化步驟中獲得了 1-2×10^13 vg/6360 cm2 面積的高產量,且有50% 完整衣殼。這種方法可以適用于懸浮培養,以放大規模,并通過制造一種 rHSV-rep-cap 病毒而不是兩種病毒來降低商品成本。在下游工藝中需要一個完善的清除方案,以去除最終 rAAV 中可能誘導宿主免疫反應的任何殘留 HSV DNA 或蛋白質。
用于重組 AAV 生產的穩定細胞系開發
在 HEK293 細胞中產生穩定細胞系的挑戰源于 E1A 的內源性表達,E1A 穩定整合到 HEK293 的基因組中。E1A 的表達可以反式激活 rep 和 cap 基因,也可以打開 E1B、E2A 和 E4 等輔助基因。Rep 的早期表達尤其具有細胞毒性,這使得獲得穩定的細胞系非常具有挑戰性。然而,穩定的細胞系對 AAV 的生產非常有利,因為它們具有多個優點,包括更好的可放大性、更少的批次間差異、更低的商品成本以及更高的產量。Yang 等人最先嘗試了為 rAAV 生產創建穩定的 HEK293 細胞系。他們用誘導型啟動子替換 p5 啟動子,以及調節 Rep78/68 的表達。然而,小 Rep 蛋白 (Rep52/40) 的表達仍然來自嵌入在 rep 基因的重疊開放閱讀框中的 p19 啟動子,因此誘導型啟動子不會導致 p5 和 p19 的時間協調表達。在 Qiao 等人的另一項研究中,他們通過在 HEK293 細胞系中設計雙剪接開關機制,來控制4種穩定整合的細胞毒性 Rep 蛋白(Rep78、Rep68、Rep52 和 Rep40)的表達。在這個系統中,一個包含轉錄終止序列的內含子盒被插入到 Rep 蛋白的重疊編碼序列中,以提前終止它們的表達,而不改變 P5 和 P19 啟動子的活性。然后通過感染攜帶 Cre 重組酶 (Ad-Cre) 的有缺陷的腺病毒來恢復所有4種 Rep 蛋白的表達。盡管他們能夠使用這種方法獲得高滴度的 rAAV,但不利的方面是,rAAV 產品中可能存在有缺陷的 Ad-Cre 的痕量污染,這仍然存在很小的風險。
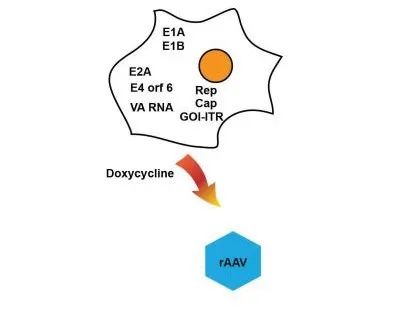
圖6. 用于rAAV生產的穩定細胞系。用于AAV生產的穩定生產細胞系攜帶所有部件,包括Rep、Cap、 E2A、E4或f6、VA RNA和GOI-ITR。E1A和E1B均為內源性表達。加入強力霉素后誘導rAAV生產。
優勢:1. 可規模放大;2. 無腺病毒;3. 可通過灌流工藝提高rAAV產量;4. 適用于藥物開發的后期。挑戰:1. 針對每個特定項目開發生產細胞系需要較長時間。
最近,研究已開發出了新的穩定 AAV 生產細胞系(圖 6)。在該技術中,首先生成穩定表達 Rep 和必需輔助蛋白的包裝細胞系,然后,通過將衣殼和轉基因質粒整合到包裝細胞系中,生成穩定生產細胞。使用多西環素誘導rAAV顆粒的表達。該系統為該領域提供了許多優勢,例如消除了瞬時轉染步驟,以及無腺病毒和可放大性。使用基于灌流生物反應器的優化工藝,可在粗收獲液中獲得 1×10^15 vg/L 的產量以及超過 30% 的 rAAV8 完整顆粒。






