來源:遠方基金
新藥研發是醫藥公司運轉的齒輪,推動公司發展,是一項投資高、風險高、周期長,競爭激烈,但利潤率高的工程。10年時間,花費10億美元,研發一款新藥,無論是利益的驅動,還是拯救萬千患者的成就感,藥企的這一行為都值得我們尊敬。
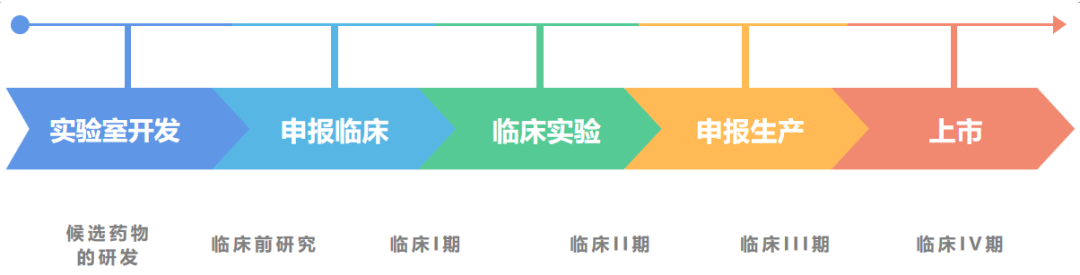
一款新藥從研發到上市,都要經歷那些過程呢?本文以小分子藥物為例,大致梳理整個流程。
新藥的研發分為兩個階段:研究和開發。這兩個階段是相繼發生有互相聯系的。區分兩個階段的標志是候選藥物的確定,即在確定候選藥物之前為研究階段,確定之后的工作為開發階段。所謂候選藥物是指擬進行系統的臨床前試驗并進入臨床研究的活性化合物。
一
新藥研究階段
研究階段包括四個重要環節,即藥物作用靶點(target)以及生物標記(biomarker)的選擇與確認、先導化合物(lead compound)的確定、構效關系的研究與活性化合物的篩選、候選藥物(candidate)的確定。
1、藥物作用靶點(target)以及生物標記(biomarker)的選擇與確認
早期人們對藥物作用靶標認識有限,往往只知道有效,但不知如何起效。比如,百年來,人們知道阿司匹林(aspirin)具有解熱、消炎、止痛、抗血栓,甚至抗癌作用。直到1971年,英國人John R. Vane 在《Nature》期刊發文才闡明了Aspirin作用機理為抑制前列腺素合成,并于1982榮獲Nobel生理和醫學獎。現代生物醫學的研究進展,以及人類基因圖譜的建立,讓人類對疾病的機理了解更加準確,為新藥開發提供了明確的方向、具體的靶標。
一般而言,藥物作用的新靶點一旦被發現,往往會成為一系列新藥發現的突破口。通俗易懂一點解釋,如果把病比作一把鎖,那么靶點為鎖芯,如若找到鎖芯,研究出鎖芯的立體結構,那么我們就可以根據它的立體結構為其配備一把專有的鑰匙,那么該新藥即為這把專有的鑰匙。
2、先導化合物(lead compound)的確定
一旦選定了藥物作用的靶標,藥物化學家(medicinal chemist)首先要找到一個對該靶標有作用的化合物。這個化合物可以來自天然產物(動物、植物、海洋生物);也可以是根據靶標的空間結構,計算機模擬設計、合成的化合物;還可以根據文獻報道或以前其它項目的研究發現。比如,某一類化合物具有作用于該靶標的藥理活性或副反應等等。目前我們常用的方法是跟蹤國外研發機構對某一靶標的藥物開發,以他們的化合物作為先導,希望設計出更優秀的化合物。
3、構效關系的研究與活性化合物的篩選
圍繞先導化合物,設計并合成大量新化合物,通過對所合成化合物活性數據與化合物結構的構效關系分析,進一步有效的指導后續的化合物結構優化和修飾,以期得到活性更好的化合物。
4、候選藥物(candidate)的確定
候選藥物的確定標志著分子設計、化學合成、生物評價循環反饋的完成,達到了新藥開發的標準。候選藥物的確定也沒有統一的標準,每個項目選擇的候選藥物數量也不盡相同,總的趨勢是要求候選藥物具有較好的成藥性,為了降低研發失敗的概率、縮短開發時間,候選藥物的選定一般要遵循以下原則。
圖表:候選藥物的確定遵循的一般原則

資料來源:藥物化學總論,中金公司研究部
二
新藥開發階段
候選藥物確定后,新藥研發就進入開發階段,開發階段主要分為以下五個環節:臨床前實驗、臨床研究、新藥申請、批準上市、上市后檢測。
圖表:新藥臨床開發過程
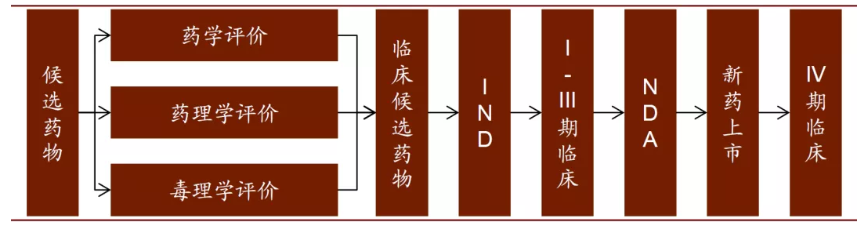
資料來源:CNKI,中金公司研究部
1、臨床前實驗
(1)化學、制造和控制(Chemical Manufacture and Control, CMC)
新藥開發工作的第一步是原料藥合成工藝研發(Process R & D),這是一個不斷改進、完善的過程。第一批提供的原料藥主要用于毒理研究(100—1000g),要求是越快越好,成本不是主要考慮因素。因此,只要藥化路線能夠實現毒理批合成,工藝研發部門就會采用。但隨著項目的推進,工藝部門會根據需要設計全新合成路線,開發合理生產工藝來滿足從I—III期臨床用藥與商業化的需求;同理,制劑部門首先也會以最簡單的形式給藥,完成毒理研究,然后不斷完成處方工藝研究,開發出商業化的制劑工藝。
(2)藥代動力學(Pharmacokinetics, PK)
了解藥物在動物體內的吸收、分布、代謝、排泄(ADME),這些數據可以指導臨床研究以何種形式給藥(口服、吸入、針劑),給藥頻率與劑量。
(3)安全性藥理(Safety Pharmacology)
證明該化合物針對特定目標疾病具有生物活性,同時評估藥物對療效以外的作用,比如可能的副作用,尤其是對心血管、呼吸、中樞神經系統的影響。
(4)毒理研究(Toxicology)
毒理研究種類較多,包括急性毒性、亞急性毒性、慢性毒性、生殖毒性、致癌性、致突變性等。為了加速新藥能及早驗證是否有療效,尤其是對一些抗癌藥,有些耗時費錢的毒理實驗(如致癌性、生殖毒性)是可容許在臨床試驗階段再進行。
(5)制劑開發
制劑開發是藥物研發的一個重要環節。早期制劑研究并不需要完整的處方開發,所有研究圍繞毒理學研究和一期臨床時方便給藥即可,目的是將候選藥物盡快推向臨床。隨著項目推進,給藥方式和處方研究就越來越全面。比如,有的藥胃腸吸收很差,就需要開發為注射劑。有的藥對在胃酸里面會失去活性,就需要開發為腸溶制劑。有的化合物溶解性不好,也可以通過制劑來部分解決這個問題。
前面這些內容都統稱為臨床前研究,是藥物開發的第一階段。臨床前各個實驗的步驟可不是嚴格按照上述這個順序展開,而是一個相互包容、相互協調的關系。比如,原料藥工藝研發部門,完成毒理批樣品合成后,就必須立即開展合成路線的選擇,開發新的合成工藝,提供足夠量的原料藥以滿足制劑部門制劑研究用原料藥和9-12個月后開展I期臨床用藥的需求。
2、臨床研究(Clinical studies)
Ⅰ期臨床試驗
在新藥開發過程中,將新藥第一次用于人體以研究新藥的性質的試驗,稱之為Ⅰ期臨床試驗。這一階段的臨床試驗一般需要征集20-100名正常和健康的志愿者(對腫瘤藥物而言通常為腫瘤病人,但人數更少),在嚴格控制的條件下,給不同劑量(隨著對新藥的安全性了解的增加,給藥的劑量也逐漸提高,并可以多劑量給藥)的藥物試驗于健康志愿者,住院以進行24小時的密切監護,仔細監測藥物的血液濃度、排泄性質和任何有益反應或不良作用,以評價藥物在人體內的性質。同時也要通過這一階段的臨床試驗獲得其吸收、分布、代謝和排泄以及藥效持續時間的數據和資料;以及藥物最高和最低劑量的信息,以便確定將來在病人身上使用的合適劑量。可見,Ⅰ期臨床試驗是初步的臨床藥理學及人體安全性評價試驗,目的在于觀測人體對新藥的耐受程度和藥代動力學,為制定給藥方案和安全劑量提供依據。
Ⅱ期臨床試驗
為了證實藥品的治療作用的,就必須在真正的病人身上進行臨床研究,即Ⅱ期臨床試驗。Ⅱ期的臨床試驗通常需要征集100-500名相關病人進行試驗。其主要目的是獲得藥物治療有效性資料。
將試驗新藥給一定數量的病人志愿者,評價藥物的藥代動力學和排泄情況。這是因為藥物在患病狀態的人體內的作用方式與健康志愿者是不同的,對那些影響腸、胃、肝、和腎的藥物尤其如此。Ⅱ期臨床試驗一般通過隨機盲法對照試驗(根據具體目的也可以采取其他設計形式),對新藥的有效性和安全性作出初步評價,并為設計Ⅲ期臨床試驗和確定給藥劑量方案提供依據。
Ⅲ期臨床試驗
當一個新藥推進到三期臨床,原料藥和制劑工藝研究也推進到了相應的階段。三期臨床用藥以商業化生產工藝提供臨床用藥。一般來講,商業化生產的原料藥生產工藝應該考慮以下因素:產品質量,生產安全性,生產成本,環境影響,生產的穩定性和可持續性。
Ⅲ期的臨床試驗通常需1000-5000名臨床和住院病人,在醫生的嚴格監控下,進一步獲得該藥物的有效性資料和鑒定副作用,以及與其他藥物的相互作用關系。該階段試驗一般將對試驗藥物和安慰劑(不含活性物質)或已上市藥品的有關參數進行對照和雙盲法試驗(醫生和病人都不知道自己吃的是新藥、老藥或安慰劑),在更大范圍的病人志愿者身上,進行擴大的多中心臨床試驗。最后,根據嚴格統計學數據分析,進一步評價藥物的有效性和耐受性(或安全性),決定新藥是否優于(superior)或不差于(not inferior)市場現有的“老藥”。Ⅲ期臨床試驗是治療作用的確證階段,也是為藥品注冊申請獲得批準提供依據的關鍵階段,該階段是臨床研究項目的最繁忙和任務最集中的部分,無疑是整個臨床試驗中最重要的一步。三期臨床研究往往持續好幾年。
除了對成年病人研究外,還要特別研究藥物對老年病人,有時還要包括兒童的安全性。一般來講,老年病人和危重病人所要求的劑量要低一些,因為他們的身體不能有效地清除藥物,使得他們對不良反應的耐受性更差,所以應當進行特別的研究來確定劑量。而兒童人群具有突變敏感性、遲發毒性和不同的藥物代謝動力學性質等特點,因此在決定藥物應用于兒童人群時,權衡療效和藥物不良反應應當是一個需要特別關注的問題。在國外,兒童參加的臨床試驗一般放在成人試驗的Ⅲ期臨床后才開始。如果一種疾病主要發生在兒童,并且很嚴重又沒有其他治療方法,美國食品與藥品管理局允許Ⅰ期臨床試驗真接從兒童開始,即在不存在成人數據參照的情況下,允許從兒童開始藥理評價。我國對此尚無明確規定。
上述任何一步反饋得到的結果不好,都有可能讓一個候選藥物胎死腹中。最悲慘的結果可能是這個項目就直接被取消了。2007年,Merck有四個三期臨床藥物失敗。
能夠通過全部3期臨床評價而上市的新藥越來越少,部分原因是開發出比市場上現有藥物綜合評價更好的新藥越來越難。而一個藥物從源頭研發到3期臨床是一個耗資巨大的過程。公開數據表明,平均下來一個新藥要花費約為十億美金(1 billion US dollars)。正是因為藥物研發的耗資巨大,大公司花不起那么多錢同時展開多個項目研究,小公司又沒有那么多的財力完成藥物研發的全部流程。現在的藥物研發的一個趨勢是,小公司反而能夠更好的找準市場上的空缺,開發出在臨床前研究階段具有良好表現的候選藥物。這時大公司通過并購小公司或者購買專利(或者使用權),將這個項目買過來繼續開發。如果是購買專利的情況,則會根據這個項目最后能夠進展到哪個階段,完成后相應得再支付給小公司一筆“獎金”,叫做milestone。
3、新藥申請(New drug application, NDA)
4、批準上市
5、IV期臨床研究(藥物上市后監測)
中國和美國在新藥研發相關流程上的不同之處

三
投資思路
(1)市場空間大
2017-2019年全球銷售前十的藥物包括了阿達木單抗、英夫利昔單抗、依那西普等自身免疫病用藥和帕博利珠單抗、納武利尤單抗、曲妥珠單抗、貝伐珠單抗、利妥昔單抗、來那度胺、伊布替尼等抗腫瘤藥(個別已經退出2019年前十大榜單),這兩個領域是大品種層出不窮的領域,市場空間和潛力均極大。
(2)大量市場需求未被滿足
目前來看大多癌癥種類依然是無法被徹底治愈的,目前抗腫瘤治療的核心思路還是延長生存期、提升生存質量,因此在各個細分領域都有持續性的推出新的突破性療法的潛力,不斷的延長生存期,提高ORR(客觀緩解率);同時由于中國和歐美國家的疾病圖譜有所差異(如中國發病率較高的消化道類癌癥在海外發病率較低),在某些領域中國未滿足的臨床需求是國產藥企的重要機遇(如胃癌等)。
(3)放量速度快
心血管等慢性病領域用藥放量速度慢,最有代表性的是信立泰的阿利沙坦酯和天士力的普佑克,上市四五年才一兩億的收入;而反觀中國生物制藥的安羅替尼,因為滿足了國內對非小細胞肺癌三線療法的需求,上市首日1.3億元銷售,2018年6-7億,2019年直奔30億了,這速度可想而知。






