灌流系統的穩健放大需要所有規模的可比條件,以確保同等的細胞培養性能。當連續工藝中的細胞在生物反應器外部循環時,如果射流和攪拌導致灌流進樣和返回之間直接連接,則可能會出現性能損失。計算流體動力學可用于識別此類短路流、評估混合效率并最終調整灌流設置。本研究調查了從 2 L 玻璃生物反應器到 100 L 和 500 L 一次性中試規模系統的規模放大。高分辨率的格子玻爾茲曼大渦(Lattice Boltzmann Large Eddy)模擬在單相中進行,混合效率 (Emix) 進一步在 2 L 系統中進行了實驗驗證。該評估可以深入了解生物反應器內的流動模式、混合行為和細胞停留時間的信息。由于在所有測試條件下 Emix 均大于 90%,因此中試規模系統無需進行幾何調整。在 2 L 規模下評估了兩種不同的設置,其中流動方向發生變化,混合效率相差 10%。盡管如此,由于確認 2 L 設置的 Emix 也 >90%,并且所有規模的確定混合時間都在相似的范圍內,因此 2 L 系統被認為是合適的縮小模型。結果證明了計算流體動力學模型如何用于生物制藥行業強化生產過程的合理工藝設計。
人口的快速增長、疾病患病率的增加以及生物制藥知識和接受度的不斷提高迫使生物制藥公司優化工藝。特別是過去幾年對單克隆抗體(mAb)的需求有所增加。大多數單克隆抗體在中國倉鼠卵巢 (CHO) 細胞中生產,并采用補料分批工藝作為首選工藝策略。然而,對更高產品產量的需求鼓勵了強化工藝策略的開發。因此,灌流工藝已成為即將推出的、利用細胞截留來提供更高細胞密度的生產技術的重要組成部分。最常見的技術,如切向流過濾 (TFF) 或交替式切向流 (ATF) 系統,都涉及中空纖維,用于將細胞繞回到生物反應器中,同時不斷置換培養基。作為 N 階段灌流或傳統補料分批工藝的替代方案,生產力較低的生長階段也可以轉移到前階段,從而在 N 階段實現更高的單位體積生產力。通過這種強化補料分批策略,與低密度種子培養相比,滴度幾乎翻倍。
不利的一面是,灌流模式也面臨著挑戰。除了技術復雜的設置增加了污染風險之外,高細胞密度還導致生物反應器中的粘度升高,從而降低混合效率。此外,噴射流和攪拌的組合可能會引起灌流進樣和回流液流之間的直接連接,從而導致短路流的形成。因此,混合在高細胞密度培養中非常重要。混合不良的反應器會導致細胞環境中的局部異質性,例如底物濃度、pH、DO 和 CO2 梯度。因此,生物反應器的整體性能可能會因極端 pH 值、DO 或底物濃度供應不足而導致細胞活性下降,進而受到損害。其后果是產品滴度降低以及產品質量超出規格。
在過去的十年中,計算流體動力學 (CFD) 已用于生物制藥環境中的多種應用或混合應用。示例性用例包括在微量滴定板中建立 kLa 模型、對冷凍容器中的熱和質量傳輸(包括相變)進行建模以及優化UF/DF 工藝,包括混合效率評估。 Radoniqi 等人之前對 ATF 組件進行了數值流模擬。然而,他們的研究重點是中空纖維的內腔和膜污染的闡明,而不是罐內的混合性能。
一般來說,如果需要瞬態方法,傳統的模擬方案在計算成本和時間方面可能非常昂貴。涉及格子玻爾茲曼大渦模擬 (LBLES) 的有前途的模擬方法在圖形處理單元 (GPU) 上并行時可加速高分辨率瞬態模擬。它們對于混合研究的有效性已在多項研究中得到證明。與以數值方式近似求解宏觀納維-斯托克斯(Navier-Stokes)和能量方程的傳統 CFD 方法不同,格子玻爾茲曼方法 (LBM) 在介觀尺度上描述流域中的粒子行為。基于 LBM 的 CFD 工具(例如 M-Star)可對格子玻爾茲曼方程 (LBE) 進行數值求解。因此,所有必要的宏觀流動變量都可以通過使用粒子分布函數和守恒定律來計算,以恢復宏觀方程,例如納維-斯托克斯方程。與其它方法相比,LBM 方法更適合具有復雜邊界的模擬。除此之外,LBM 方法運行速度更快,因為 LBE 可以通過僅考慮線性流和碰撞過程來計算,而不是構造宏觀連續方程,其中發生高階計算。因此,這種方法特別適合描述連續灌流過程中存在的復雜混合現象的瞬態行為。
在這項工作中,目的是表征不同規模的灌流生物反應器的混合性能,以降低工藝失敗的風險。最初,對 2 L 規模縮小灌流反應器進行了實驗研究。獲得的實驗數據隨后用于驗證從格子玻爾茲曼方法 (LBM) CFD 模擬中檢索到的混合效率。此外,還對100 L和500 L中試規模進行了模擬研究。除了混合效率外,還確定了流動模式和細胞停留時間,支持對不同規模的灌流系統的評估。
詳細實驗操作和結果,請參考原文。
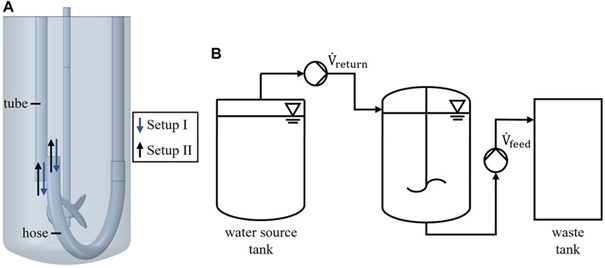
圖 1. 反應器裝置 (A),實驗裝置示意圖 (B)。
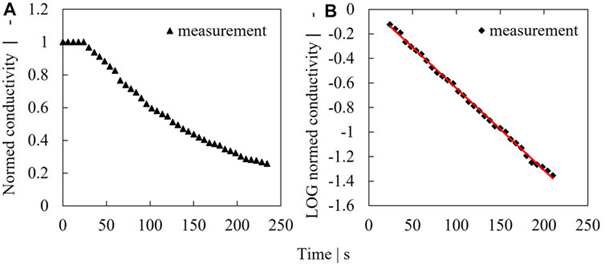
圖 2. 稀釋率測定示例。葉輪速度為 250 rpm 時測得的電導率信號 (A),對數濃度 (B)。
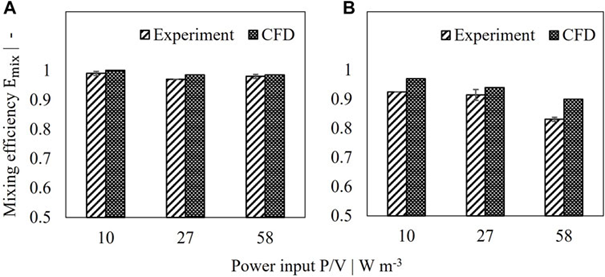
圖 3. 2 L 灌流罐的模擬和測量混合效率比較。 (A) 設置 I,(B) 設置 II。
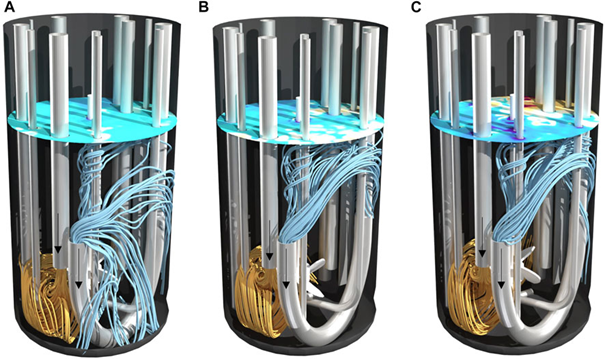
圖 4. 設置 I 的 2 L 生物反應器在不同功率輸入 (A) 10 W/m3、(B) 27 W/m3 和 (C) 58 W/m3 下的流線。以橙色向前計算的流線為流入,以藍色向后計算的流線為流出。表面顏色表示渦流的拓撲結構。
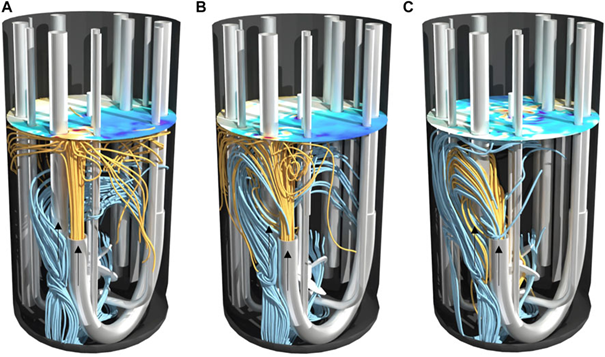
圖 5. 設置 II 的 2 L 生物反應器在不同功率輸入 (A) 10 W/m3、(B) 27 W/m3 和 (C) 58 W/m3 下的流線。以橙色向前計算的流線為流入,以藍色向后計算的流線為流出。表面顏色表示渦流的拓撲結構。
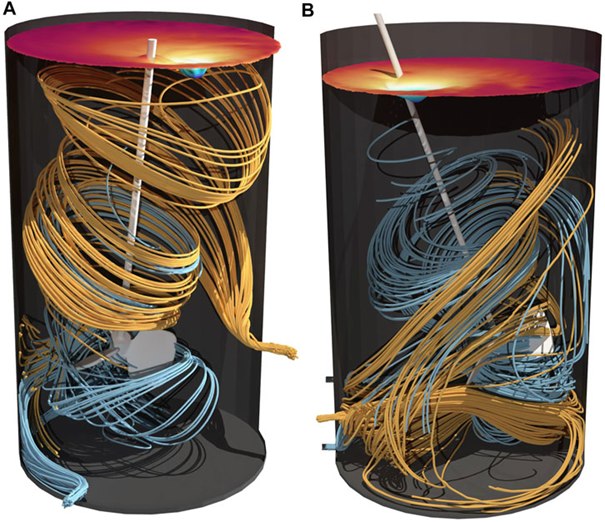
圖 6. 100 L (A) 和 500 L (B) 灌流生物反應器中的流線。以橙色向前計算的流線為流入,以藍色向后計算的流線為流出。表面顏色表示渦流的拓撲結構。
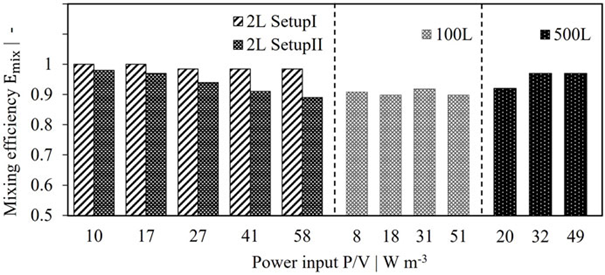
圖 7. 2 L、100 L 和 500 L 灌流系統的混合效率比較。
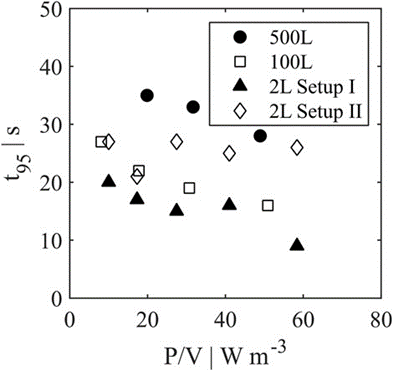
圖 8. 2 L、100 L 和 500 L 灌流系統的混合時間 t95 比較。
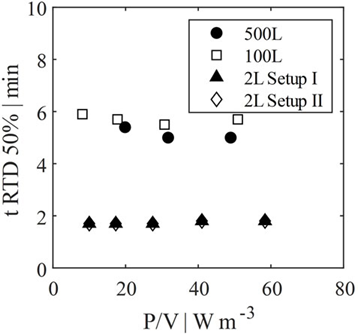
圖 9. 2 L、100 L 和 500 L 灌流系統的停留時間分布比較。
總結
確定混合效率和防止短路流動是灌流系統表征和優化的重要組成部分。為了確保穩健的工藝性能,此類標準應在不同規模之間保持不變。格子玻爾茲曼大渦模擬已被證明是能夠進行高分辨率瞬態模擬的有價值的工具。本研究展示了通過 LBLES 評估混合效率及其在 2 L 實驗室規模灌流反應器中的驗證。模擬與實驗之間的差異低于 5%,但兩種反應器設置和多個功率輸入的差異為 8%。
通過模擬灌流反應器中細胞的流動模式、混合效率、混合時間和停留時間分布,研究了放大到 100 L 和 500 L 中試規模的情況。在所有情況下,混合效率均達到>90%。因此,不需要對反應器系統進行幾何改造。考慮到檢查的標準,2 L 系統被證明是適合中試規模灌流的規模縮小模型。設置 II 的結果稍微更好地匹配中試規模性能,但是,兩個實驗室規模反應器設置的差異被認為是不重要的。總之,建議在放大灌流工藝中采用這種 LBLES 方法作為風險緩解措施,以防止短路流導致的工藝失敗。由于本研究僅包括單相模擬,因此未來的工作應重點關注多相系統。如果考慮氣相,流動模式會有所不同,可能會導致混合時間和效率的改變。最終,所有模擬結果都必須通過細胞培養來證實。
原文:M.Kuschel, J.Wutz, M.Salli, et al., CFD supported scale up of perfusion bioreactors in biopharma. Front. Chem. Eng., 2023.






